近日,上海理工大学庄松林院士、国家级人才张大伟教授领导的超精密光学制造创新团队在国际高水平期刊《先进功能材料》《Advance Functional Materials》上发表了题为“光免疫介导的GSDME依赖的焦亡重塑肿瘤免疫微环境”(Nanoagonist-mediated GSDME dependent Pyroptosis Remodels the Inflammatory Microenvironment for Tumor Phot-oimmunotherapy)的重要突破成果,该成果和上海交通大学附属新华医院、长海医院合作,研究构建了一种新型的光免疫纳米材料载药体系,通过诱导癌细胞焦亡的方式引起肿瘤部位炎性微环境的改变,增强免疫浸润程度,激活机体免疫应答能力,并且解决免疫检查点抑制剂失效的问题,为黑色素瘤的治疗提供了一种新的方法。光电学院郑璐璐副教授,研究生范岩,材化学院研究生王翔为文章的共同第一作者,光电学院张大伟教授与材化学院李钰皓副教授为文章的通讯作者。该期刊是Wiley出版社旗下的国际材料科学领域最高层次综合性期刊之一,为Nature Index收录期刊,中科院JCR分区为一区,影响因子为19.924。期刊致力于报道材料科学取得的突破性进展,以其高质量的内容和高影响力而闻名,涉及领域包括纳米技术、化学、物理学和生物学。

图一 论文页面截图
光动力治疗是众多肿瘤治疗手段之中最为有效的方法之一,其具有无创、毒副作用低等特点;而细胞焦亡作为程序性死亡方式之一,其与机体免疫系统的关系最为紧密,被广泛应用于肿瘤的免疫治疗。但是,黑色素瘤患者在其免疫微环境中缺乏淋巴细胞浸润,导致免疫增强类药物无法发挥其治疗效果,这种肿瘤被称为“冷肿瘤”。本研究结合光动力治疗以及细胞凋亡的原理,设计出一种以铱配合物为基质材料的纳米光敏剂IrP,该纳米材料能够在520nm激光的照射下刺激细胞产生大量的活性氧,诱导细胞焦亡相关蛋白Caspase-3的表达,同时利用IrP的自组装特性,进一步包覆去甲基化药物RG108,构建出光免疫纳米载药体系R@IrP,重构肿瘤部位的炎性微环境,促进机体的免疫细胞浸润到肿瘤部位,将黑色素瘤由“冷肿瘤”转换为“热肿瘤”,同时结合免疫检查点抑制剂anti-PD-1的协同治疗,发挥免疫检查点抑制剂的最大功效,其治疗效果提升了约95%,解决了免疫检查点抑制剂anti-PD-1在作用于“冷肿瘤”时失效的问题,为黑色素瘤的免疫治疗提供了一种无创的、高效的手段。
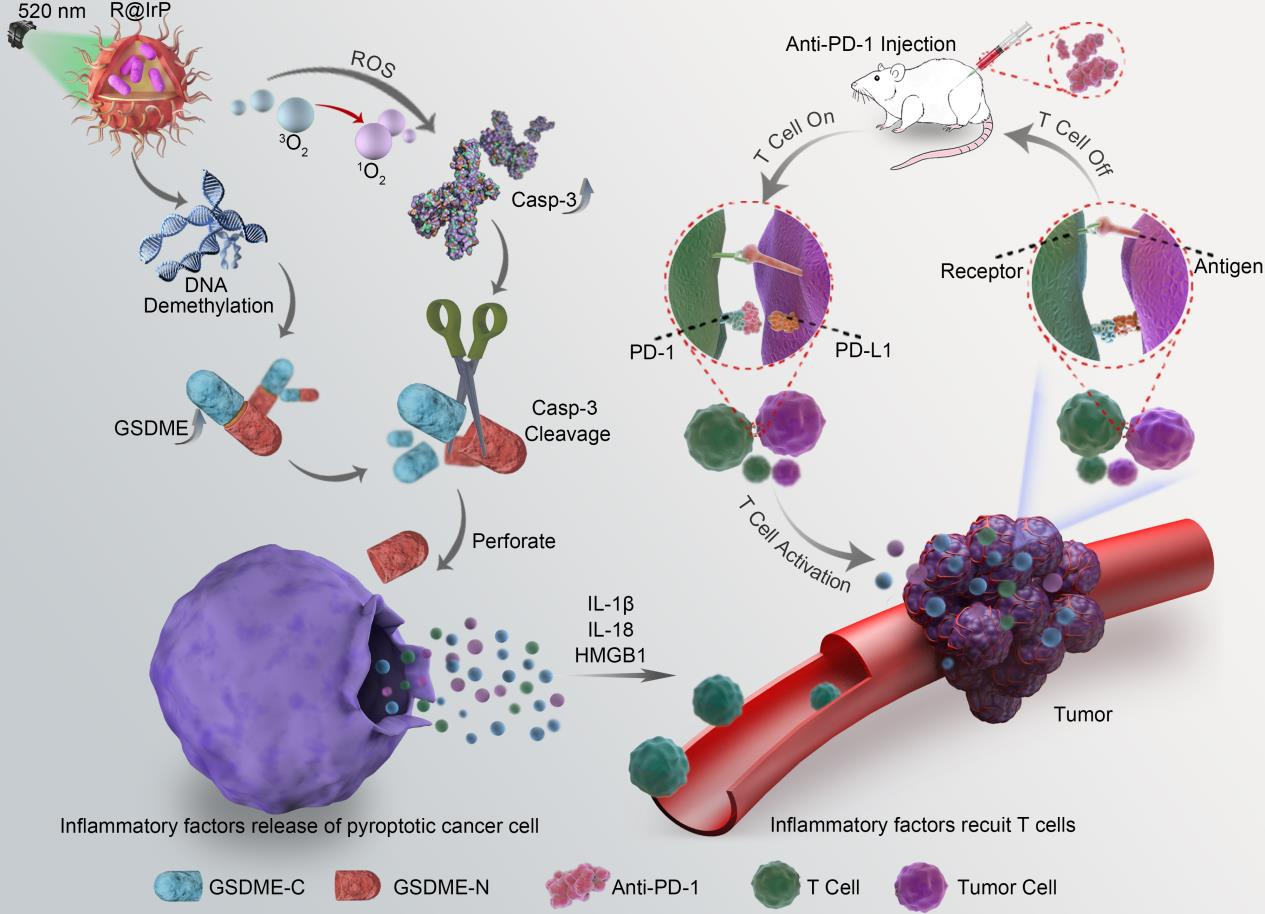
图一 光免疫纳米材料在体内的作用机理示意图
免疫治疗一直是当今医学治疗肿瘤的重要手段,该研究与传统的治疗手段相比,其最大程度上激活了机体自身的免疫机制,阻止了免疫逃避现象的发生,为肿瘤的免疫治疗提供了颠覆性的思路。
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202200811

